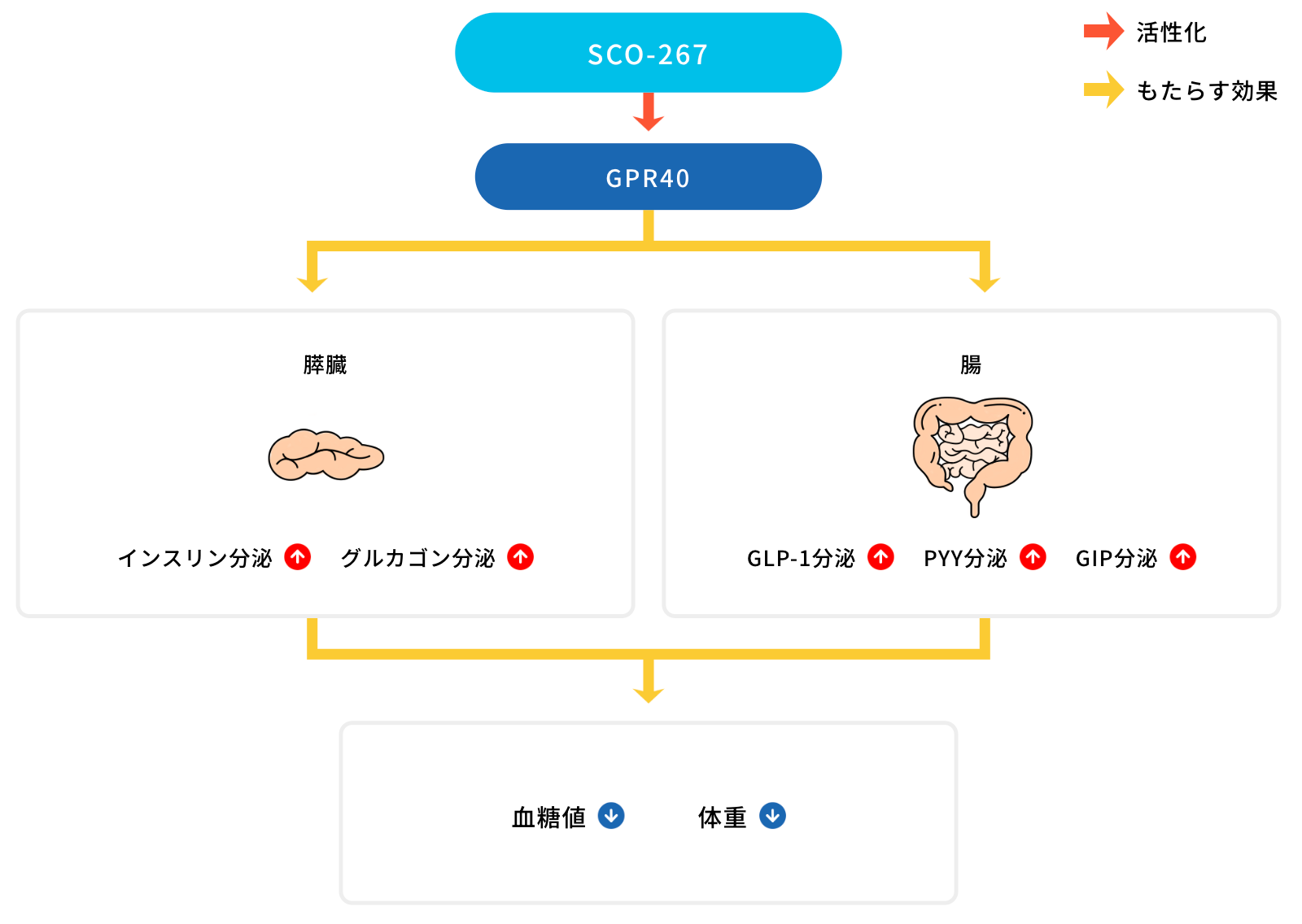
GPR40は中~長鎖脂肪酸を内因性リガンドとするGタンパク質共役型受容体(GPCR)であり、膵臓のベータ細胞および腸管内分泌細胞からのインスリンおよびインクレチン[glucagon-like peptide-1
(GLP-1)およびglucose-dependent insulinotropic polypeptide (GIP)]分泌を生理的に制御していることが知られています。インスリン分泌促進やインクレチン活性増強は臨床において代謝疾患や肥満に対する治療効果を有することが分かっており、GPR40は新しい創薬標的として注目されています。
GPR40には複数の低分子結合サイトが存在することが分かっており、この内の一箇所に結合するGPR40パーシャルアゴニストであるファシグリファムは主にインスリン分泌を促進することにより2型糖尿病患者さんの血糖コントロールを改善できることが証明されています。
スコヒアファーマの研究員を含むグループによって同定されたSCO-267は新しい化学構造をもち、ファシグリファムとは異なる受容体部位に結合するGPR40フルアゴニストです。インスリン分泌促進作用が主な薬理作用であるGPR40パーシャルアゴニストに対し、GPR40フルアゴニストは更に膵島および腸管ホルモンの分泌を促進できます。
フェーズ1試験において糖尿病患者さんにSCO-267を単回投与したところ、膵島および腸管ホルモンの分泌が促進され、患者さんの耐糖能が著しく改善されることが確認されました。
前臨床試験においてSCO-267は代謝および体重制御に主要な役割を持つインスリン、GLP-1、GIPおよびpeptide YY (PYY)分泌を促進することが確認できており、肥満モデルにおける体重低下作用に加え、GPR40パーシャルアゴニストやDPP4阻害薬を明確に上回る血糖改善作用が確認されています。さらに、SCO-267は肝臓の機能維持や代謝制御に主要な役割を有するグルカゴン分泌を促進することができ、肝臓病モデルの肝指標を改善することが確認されています。
このような薬効特性からSCO-267は糖尿病、肥満およびNASH(非アルコール性脂肪肝炎)の新しい治療戦略になると期待され、現在フェーズ2試験実施に向け準備中です。
現在、当社は SCO-267の全世界における開発および商業化パートナーを探しています。
パートナリングに関するお問合せはこちらまで。
適応症 :
- 糖尿病
- 肥満症
- 非アルコール性脂肪肝炎(NASH)
- GLP-1 : Glucagon-like peptide 1
- PYY : Peptide YY
- GIP : Glucose-dependent insulinotropic polypeptide
Clinical Trial Information
-
GPR40 フルアゴニスト(SCO-267)のフェーズ 1 試験開始のお知らせ
リンク
Scientific Presentation
-
SCO-267の臨床試験成績を第81回米国糖尿病学会年次学術集会で発表:ファースト・イン・クラスのポテンシャルを有するGPR40フルアゴニストのフェーズ1試験成績を報告
リンク -
GPR40フルアゴニスト(SCO-267)の創薬化学研究に関する学会発表について
リンク -
Design and Identification of a GPR40 Full Agonist (SCO-267) Possessing a 2-Carbamoylphenyl Piperidine Moiety for the Treatment of Type 2 Diabetes Mellitus
・EFMC-ISMC Virtual Event 2020
リンク -
Discovery of SCO-267, a First-in-class GPR40 Full Agonist, as a Promising Candidate for the Treatment of Type 2 Diabetes Mellitus, Obesity, and NASH
・EFMC-ISMC Virtual Event 2020
リンク -
SCO-267, a GPR40 Full Agonist, Improves Glycemic and Body Weight Control More Than That by Fasiglifam in Rat Models of Diabetes and Obesity
・79th Scientific Sessions of American Diabetes Association held June 7-11, 2019, San Francisco, California, USA.
リンク
Scientific Publication
-
GPR40 フルアゴニスト(SCO-267)のフェーズ1試験に関する論文掲載につい て; SCO-267 は良好な安全性、忍容性及び薬物動態プロファイルを示し糖尿病 患者の血糖コントロールを改善する
リンク -
GPR40フルアゴニスト(SCO-267)の前臨床試験に関する論文掲載について; SCO-267の慢性暴露は糖尿病治療に対し持続的に有効である
リンク -
Design and Identification of a GPR40 Full Agonist (SCO-267) Possessing a 2-Carbamoylphenyl Piperidine Moiety
・Journal of Medicinal Chemistry
リンク -
The GPR40 full agonist SCO-267 improves liver parameters in a mouse model of nonalcoholic fatty liver disease without affecting glucose or body weight
・Journal of Pharmacology and Experimental Therapeutics
リンク -
SCO-267, a GPR40 full agonist, improves glycemic and body weight control in rat models of diabetes and obesity
・Journal of Pharmacology and Experimental Therapeutics
リンク

